Altersbedingte Makuladegeneration (AMD): Neue Therapien
-3.png)
Der Kampf gegen die altersbedingte Makuladegeneration (AMD) wird sich auf molekularer Ebene entscheiden. Wie die Krankheit zum Sehverlust führt und welche Therapien das künftig verhindern könnten.
Preisfrage: Welche Erkrankung führt hierzulande am häufigsten zu Erblindung? Glaukom? Diabetes? Richtig ist: die AMD. Etwa 4,5 Millionen Menschen sind allein in Deutschland betroffen. Oft nehmen sie Gegenstände verzerrt wahr oder leiden unter grauen Schatten im zentralen Gesichtsfeld . Schreitet die Degeneration fort, kommt es zum Verlust des zentralen Sehens. Aufgrund des demografischen Wandels wird uns dieses Krankheitsbild zukünftig immer häufiger begegnen – auch in Klinik und Allgemeinmedizinpraxis.
Wer die AMD verstehen will, muss die Anatomie des Auges kennen
Zur Erinnerung: Die Erkrankung spielt sich im Bereich des gelben Flecks (Macula lutea) ab, wo auch der Punkt des schärfsten Sehens liegt. Hier befinden sich besonders viele Photorezeptoren. Sie sitzen dem retinalen Pigmentepithel (RPE) auf, das sie mit Sauerstoff und Nährstoffen versorgt. Außerdem beseitigt das RPE Abfallprodukte, indem es sie zu den Gefäßen der Aderhaut (Choroidea) transportiert. Diesem Austausch ist die Bruch-Membran zwischengeschaltet, die zwischen RPE und Aderhaut sitzt und den Transfer reguliert. Alle drei Strukturen spielen eine entscheidende Rolle bei der Entstehung der AMD.
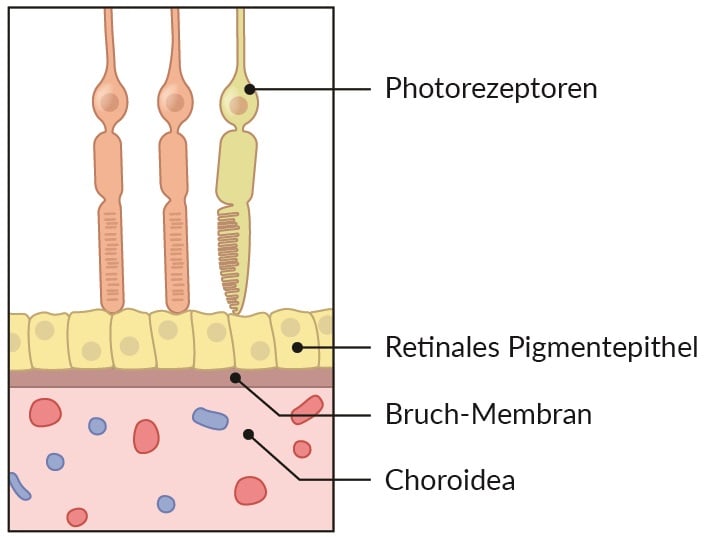
© AMBOSS GmbH
Schematische Darstellung der krankheitsrelevanten Strukturen bei AMD
Ein Teufelskreis
Mit zunehmendem Alter nimmt die Anzahl der Blutgefäße in der Aderhaut ab. Das ist insbesondere für die Entsorgung von Abfallprodukten problematisch, denn Photorezeptoren wirtschaften nicht gerade nachhaltig: Ihre Außensegmente verschleißen bei der Arbeit große Mengen Membranscheibchen. Pro Tag muss eine einzelne RPE-Zelle ca. 200.000 dieser Scheibchen loswerden. Im Alter können RPE-Zellen den anfallenden Zellschrott aufgrund mangelnder Blutversorgung nicht mehr adäquat beseitigen und sterben ab. In der Bruch-Membran sammeln sich dann inkomplett abgebaute Scheibchen, metabolische Abfallprodukte und weiteres lipidreiches Material, woraus sich sogenannte Drusen bilden (siehe Bild unten). Diese blockieren nicht nur den Transit zwischen RPE und Aderhaut, sondern enthalten auch proinflammatorische Faktoren, die wiederum eine Immunreaktion hervorrufen. Dadurch gehen weitere Blutgefäße in der Aderhaut verloren und der Teufelskreis schließt sich. Ohne das RPE fehlt den Photorezeptoren die Lebensgrundlage: Auch sie sterben ab.
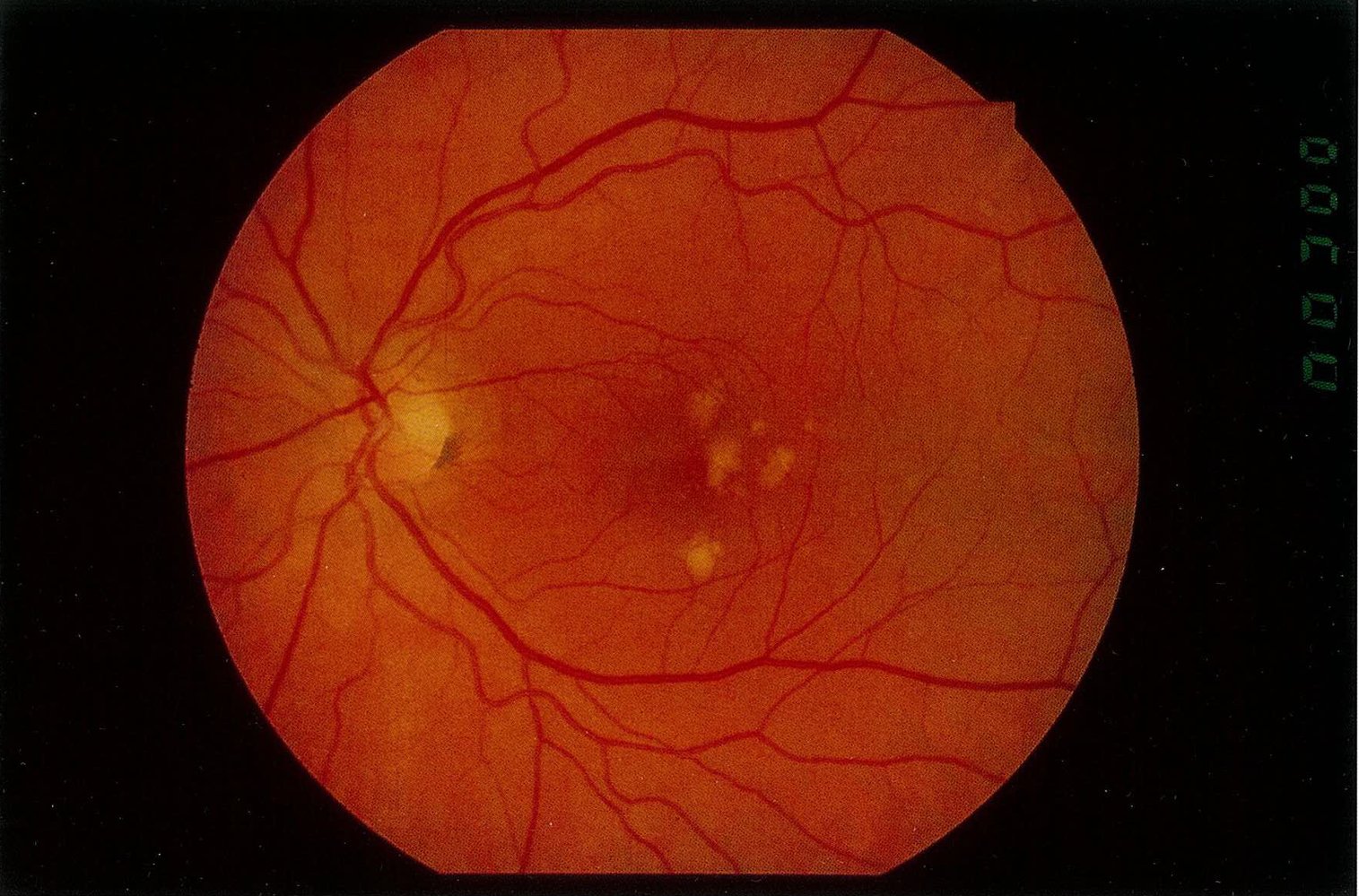
© Institut für medizinische und pharmazeutische Prüfungsfragen
Drusen im Bereich der Makula
Zwei Formen: feuchte und trockene AMD
Die Drusen führen bei beiden Formen der AMD zu einer gestörten Perfusion der Aderhautgefäße. Wohl um einer Hypoxie entgegenzusteuern, schüttet der Körper bei der feuchten AMD Vascular Endothelial Growth Factor (VEGF) aus. Neue Gefäße bilden sich, sprießen in die Bruch-Membran ein und umgeben die Drusen. Die Wände dieser Gefäße sind teilweise undicht, es kommt zu Exsudationen oder auch Blutungen. Wegen dieser Flüssigkeitsansammlungen nennt man diese Form feuchte AMD.
Doch bei den meisten Betroffenen treten keine Neovaskularisationen auf. In etwa 80% der Fälle gehen mit der Zeit immer mehr Aderhautgefäße verloren, sodass es zur “geografischen Atrophie” kommt, einem flächenhaften Absterben des RPE und der darüberliegenden Photorezeptoren. Schleichend stellt sich ein Sehverlust ein. In Abgrenzung zur feuchten AMD nennt man diese Form trockene AMD.
Neue Therapieoptionen für die altersbedingte Makuladegeneration
Während sich der Progress der feuchten AMD teilweise mit VEGF-Inhibitoren oder Lasertherapie verlangsamen lässt, fehlen effektive Therapiemöglichkeiten für die viel häufigere, trockene Form bislang. Neue Therapieansätze könnten bei beiden Formen helfen.
Neue RPE-Zellen
Eine Idee: Gelänge es, Areale mit untergehenden RPE-Zellen wieder “aufzuforsten”, bliebe der Stoffaustausch erhalten und das Überleben der Photorezeptoren wäre gesichert. Forschende einer amerikanischen Phase-II-Studie gewannen RPE-Zellen aus embryonalen Stammzellen und injizierten sie im Anschluss subretinal. Bei den neun untersuchten Personen mit AMD zeigte sich sechs Monate nach der Behandlung ein stabilisierter oder sogar verbesserter Visus.
In einer britischen Phase-I-Studie wurden RPE-Zellen auf einer synthetischen Membran befestigt und mikrochirurgisch subretinal implantiert. Um eine Abstoßung zu verhindern, wurden lokale Immunsuppressiva appliziert. Auch hier zeigten die Probanden innerhalb der zwölfmonatigen Nachbeobachtung verbesserte Sehleistungen.
Gedrosselte Immunreaktion
Eine weitere Idee setzt am Komplementsystem an: Dieser Teil der unspezifischen Immunabwehr scheint maßgeblich an der inflammatorischen Reaktion des Körpers gegen die Drusen beteiligt zu sein. Ließen sich die Signalkaskaden der Komplementfaktoren behindern, gingen weniger Blutgefäße in der Aderhaut verloren und der oben beschriebene Teufelskreis würde sich zumindest verlangsamen.
Dem Faktor C3 kommt bei der Aktivierung der Komplementkaskaden eine Schlüsselrolle zu. Eine randomisierte Phase-II-Studie hat deshalb die Wirkung des C3-Inhibitors Pegcetacoplan bei AMD untersucht. Insgesamt 165 Betroffenen wurde der Wirkstoff in den Glaskörper injiziert. Im Vergleich zur Kontrollgruppe (n=81) ließ sich der Progress der geografischen Atrophie nach sechs Monaten um bis zu 45% reduzieren.
Auch die retinale Gentherapie nimmt C3 ins Visier. Über virale Vektoren kann beispielsweise ein Plasmid-Konstrukt in RPE-Zellen eingebracht werden, das für einen C3-inhibierenden Komplex codiert. Die Zellen produzieren daraufhin diesen C3-Inhibitor und schützen sich so vor ihrer Zerstörung.
Ein Hoffnungsschimmer
Die vorgestellten Ansätze geben Anlass zur Hoffnung, weitere werden aktuell klinisch erprobt. Gemeinsam könnten sie dazu beitragen, den Sehverlust von Millionen von AMD-Betroffenen abzubremsen oder – wie im Falle der RPE-Implantate – die Sehkraft sogar wieder zu verbessern. Bevor die Wirkstoffe freigegeben werden, sind allerdings weitere klinische Studien zu möglichen Nebenwirkungen dringend erforderlich, insbesondere hinsichtlich etwaiger Infektionen oder Mutagenität.
Wie und wann der Kampf gegen die AMD endgültig entschieden sein wird, ist noch nicht abzusehen. Der Wendepunkt ist aber möglicherweise bereits erreicht.
Das AMBOSS-Kapitel AMD bietet einen fundierten Überblick über Ätiologie, Diagnostik und Therapie.
Weitere Informationen zu den Themen Auge und Sehprozess gibt es in den AMBOSS-Kapiteln Auge und Orbita und Visuelles System.
Quellen
- Pfau N, Kern O, Wolfram Ch et al. GBE-Themenheft Blindheit und Sehbehinderung . Gesundheitsberichterstattung des Bundes, 2017.Gemeinsam getragen von RKI und Destatis. doi: 10.17886/RKI-GBE-2017-002
- Schwartz SD, Regillo CD, Lam BL, et al. Human embryonic stem cell-derived retinal pigment epithelium in patients with age-related macular degeneration and Stargardt's macular dystrophy: follow-up of two open-label phase 1/2 studies. Lancet. 2015;385(9967):509-516. doi:10.1016/S0140-6736(14)61376-3
- Michael Eisenstein. A visual guide to repairing the retina. Nature 600, S2-S3 (2021). doi: https://doi.org/10.1038/d41586-021-03575-3
- Park YG, Park YS, Kim IB. Complement System and Potential Therapeutics in Age-Related Macular Degeneration. Int J Mol Sci. 2021;22(13):6851. Published 2021 Jun 25. doi:10.3390/ijms22136851